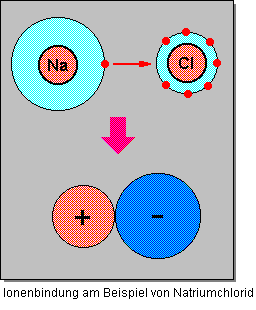
Ionenbindungen entstehen, wenn sich elektropositive und elektronegative Elemente miteinander verbinden. Die Verbindung entsteht durch den Übergang von Elektronen des einen Atoms auf das des anderen. Dabei findet eine Ladungsverschiebung statt und es wird kein gemeinsames Elektronenpaar gebildet wie bei der Atombindung, sondern es entstehen positive und negative Ionen. Edelgaskonfiguration wird also entweder durch die Aufnahme oder die Abgabe eines Elektrons erzielt. Dabei entsteht ein nach außen hin elektrisch neutrales Molekül. – Dieser Bindungstyp ist typisch für Verbindungen aus elektropositiven Metallen und elektronegativen Nichtmetallen; er wird auch heteropolare oder ionogene Bindung genannt.
Die Ionenbindung ist charakteristisch für Salze. Alle Ionenverbindungen haben salzartigen Charakter. Bei einer Ionenbindung wirken zwischen den entgegengesetzt geladenen Ionen elektrostatische Anziehungskräfte. Der Vorgang zur Bildung einer Ionenbindung ist recht kompliziert und sollte zum besseren Verständnis in Teilschritte zerlegt werden.
- Damit ein Metall und ein Nichtmetall miteinander reagieren können, müssen freie Atome vorliegen. Um diese freien Atome zu erhalten muß bei beiden Reaktionspartnern ein bestimmter Energiebetrag aufgewendet werden: bei Metallen nennt man diese Energie Sublimationenergie und bei Nichtmetallen Bindungsenergie.
- Auch bei der Bildung positiver Ionen muß Energie aufgewendet werden (Ionisierungsenergie); bei der Bildung von einfach negativgeladener Ionen wird hingegen Energie freigesetzt (Elektronenaffinität).
- Die entstandenen Ionen treten miteinander in Wechselwirkung, was zunächst zur Bildung von Ionenpaaren führt.
- Aus den Ionenpaaren bilden sich dann Ionengitter. Bei der Bildung der Ionengitter wird Coulomb’sche Energie frei.
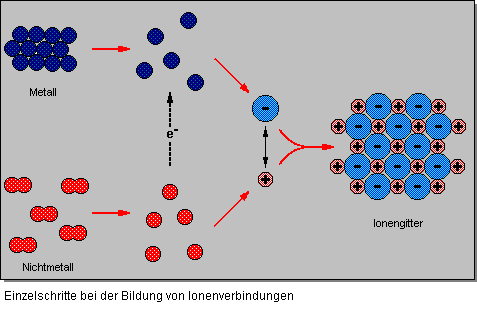
Zwischen entgegengesetzt geladenen Ionen im Gitter bestehen – wie bereits gesagt – elektrostatische Anziehungskräfte – sog. Coulomb’sche Kräfte oder Gitterenergie genannt. Diese Anziehungskräfte wirken nach allen Seiten gleichmäßig. Daraus ergibt sich eine typische räumliche Anordnung der entgegengesetzt geladenen Ionen im Kristallgitter. In Natriumchlorid beispielsweise ordnen sich die Ionen zu einem kubisch-flächenzentrierten Gitter an.
